Forma uwalniania substancji leczniczej w dużej mierze determinuje jej drogę podawania do organizmu. Po dostaniu się leku do organizmu rozpoczynają się jednocześnie dwa procesy:
Zmiana stężenia leku w czasie. Procesy te są ilościowo opisane za pomocą farmakokinetyki.
Interakcja substancji leczniczej z molekularnymi celami działania w narządach i tkankach organizmu, które określają efekt terapeutyczny i działania niepożądane leku. Zagadnienia te są badane za pomocą farmakodynamiki.
- Punkty 1-6 dotyczą rodziców i opiekunów.
- Ten ostatni to specjalny akapit, który powinien przeczytać dziecko lub nastolatek.
Wskazówki dotyczące stosowania Ritalin?
Ritalin stosuje się w leczeniu „zaburzenia nadpobudliwości z deficytem uwagi”. Stosuje się go tylko po zastosowaniu innych zabiegów, które nie wymagają stosowania leków, takich jak terapia podtrzymująca i terapia behawioralna. Jest stosowany u dzieci i młodzieży w wieku od 6 do 18 lat. . Nie wiadomo, czy Ritalin jest bezpieczny czy skuteczny w tych populacjach pacjentów.
Zależność między farmakokinetyką i farmakodynamiką pokazano schematycznie na rycinie 1.4. Oba te procesy odgrywają ważną rolę w mechanizmach działania leków; bez nich rozwój efektu terapeutycznego jest niemożliwy. W rzeczywistych warunkach nie ma wyraźnego rozróżnienia między procesami farmakokinetycznymi i farmakodynamicznymi. Naruszenie dowolnego składnika prowadzi do zmiany stężenia leku w miejscu działania i odpowiednio do zmniejszenia skuteczności terapii lub zwiększenia prawdopodobieństwa wystąpienia działań niepożądanych.
Ritalin poprawia aktywność niektórych obszarów mózgu, które są mniej aktywne. Leki mogą poprawić uwagę, koncentrację i zmniejszyć impulsywne zachowania. Lek jest dostarczany w ramach kompleksowego programu leczenia, który zwykle obejmuje.
Terapia psychologiczna, terapia edukacyjna i socjoterapia. . Jest przepisywany tylko przez lekarzy, którzy mają doświadczenie z zaburzeniami zachowania u dzieci lub młodzieży. Ciężko jest usiąść i trudno się skoncentrować. . To nie ich wina, że \u200b\u200bnie mogą tego zrobić.
Przyjmowanie metylofenidatu z alkoholem
Opis wyglądu Ritalin i zawartość opakowania
Tabletki Ritalin są dostępne w dawce: 10 mg. Nie wszystkie paczki mogą być sprzedawane. Informacje te zostały przygotowane, abyś mógł poznać podstawowe cechy swojego leku zwanego Ritalin. Jeśli nie lubisz czytać, ktoś taki jak mama, tata lub osoba, która się tobą opiekuje, mogą je przeczytać i odpowiedzieć na wszelkie pytania.Tabela 1.7
Stężenie substancji leczniczej w osoczu krwi i miejsce działania, a także rozwój efektów terapeutycznych i działań niepożądanych są określone przez reżim dawkowania substancji leczniczej.
Dawka - ilość leku na dawkę. Przydziel jedną dawkę dzienną i kursową. W pojedynczych dawkach leki są zwykle przepisywane do interwencji w nagłych wypadkach w zakresie funkcji życiowych organizmu. Działanie tych leki zwykle objawia się dość szybko. W dawkach dziennych leki są zwykle przepisywane z kumulatywnym (skumulowanym) efektem. W takim przypadku dzienną dawkę można podzielić na kilka dawek. W dawkach oczywiście przepisywane są leki o opóźnionym działaniu terapeutycznym. W przypadku niektórych leków tego typu dobrano empirycznie schematy podawania, które określają ilość substancji leczniczej, którą należy podać jednego lub drugiego dnia terapii.
Może to pomóc w czytaniu małych kawałków na raz. Podczas przyjmowania tego leku. Jeśli zażywasz ten lek częściej niż raz dziennie, może się zdarzyć, że musisz pamiętać, że przyjmujesz go w szkole. Twoja mama, ojciec lub opiekun będą musieli sprawdzić, jakie są zasady szkolne. Nie pij alkoholu Alkohol może nasilać działania niepożądane tego leku. Dziewczęta powinny natychmiast poinformować lekarza, jeśli podejrzewa, że \u200b\u200bjest w ciąży. Nie wiemy, jak wpływa to na lek na nienarodzone dziecko. Jeśli masz aktywność seksualną, porozmawiaj ze swoim lekarzem na temat metod kontroli urodzeń. Może się to zdarzyć podczas wakacji szkolnych. . Niektóre osoby nie mogą przyjmować tego leku.
Zazwyczaj stosuje się metodę eksperymentalną w celu określenia dawek leków i oceny ich bezpieczeństwa. Z jego pomocą zwierzęta doświadczalne określają skuteczne, toksyczne i śmiertelne dawki w praktyce eksperymentalnej.
Przez skuteczne rozumie się dawkę, która wywołuje pewien efekt farmakologiczny, na przykład przeciwnadciśnieniowy, przeciwzapalny. Toksyczny to dawka prowadząca do rozwoju toksycznych powikłań. Śmiertelny - dawka prowadząca do śmierci zwierząt doświadczalnych. Dawki te są powszechnie określane jako ED (dawka skuteczna), TD (dawka toksyczna) i LD (dawka śmiertelna).
Nie możesz przyjąć tego leku, jeśli. Masz chorobę serca, czujesz się bardzo nieszczęśliwy, przygnębiony lub masz zaburzenie psychiczne. Niektóre osoby powinny porozmawiać z lekarzem przed przyjęciem tego leku. Jeśli powinieneś porozmawiać z lekarzem.
Cierpisz na epilepsję, że jesteś w ciąży lub karmisz piersią podczas przyjmowania innych leków - lekarz musi znać wszystkie przyjmowane leki. Jak przyjmować lekarstwa?
- Połknąć lek popijając wodą.
- Lekarz powie ci, ile razy dziennie potrzebujesz leku.
- Nie należy przerywać przyjmowania leku przed rozmową z lekarzem.
Najczęściej określa się EDP ED50, ED99, TDP TD50, TD99, LDJ, LD50 i LD99, to znaczy dawki, które spowodowały efekt (na przykład śmierć) w 1; 50 i 99% badanych zwierząt. ED1 charakteryzuje więc minimalną dawkę, która może mieć działanie farmakologiczne, ED50 - dawka, która wywołuje efekt u połowy badanych zwierząt, ED99 - dawka, która wywołuje efekt u prawie wszystkich zwierząt.
Działania niepożądane to niepożądane rzeczy, które mogą wystąpić podczas przyjmowania leku. Jeśli tak się stanie, natychmiast porozmawiaj z osobą dorosłą na temat osoby, której ufasz, która może powiedzieć o tym lekarzowi. Najważniejsze, co może ci się przydarzyć. Być bardzo przygnębionym i nieszczęśliwym lub pragnąć bólu. Będąc w innym niż zwykle nastroju nie można zasnąć. Erupcje skóry, łatwo pojawiające się siniaki pozostają martwe. Medycyna może również powodować senność. Jeśli czujesz się senny, ważne jest, aby nie uprawiać sportów na świeżym powietrzu, takich jak jazda na rowerze lub jazda na rowerze, pływanie lub wspinanie się na drzewa, możesz zaszkodzić sobie i innym, serce bije szybciej niż zwykle.
- Nudności, wymioty lub ból brzucha.
- Może się to zdarzyć tylko po rozpoczęciu przyjmowania leku.
- Lepiej brać lek z jedzeniem.
- Poczuj się podekscytowany lub zdenerwowany.
- Zawroty głowy lub ból głowy
Należy zauważyć, że dla tej samej substancji leczniczej skuteczna dawka może się różnić w zależności od pożądanego efektu. Tak więc dla osoby dorosłej skuteczna dawka kwasu acetylosalicylowego jako środka przeciwzakrzepowego wynosi 0,075-0,5 g / dzień, a jako środek przeciwreumatyczny - 3 g / dzień.
Pamiętaj, aby przechowywać lek w bezpiecznym miejscu, aby nikt inny nie mógł go wziąć, zwłaszcza młodsi bracia i siostry. Ten lek ma dla Ciebie szczególne znaczenie - nie pozwól, aby ktokolwiek go zażył. W przypadku pominięcia zastosowania leku następnym razem nie należy przyjmować dwóch tabletek, lecz jak zwykle tylko jedną. Jeśli zażyjesz zbyt dużo lekarstw, natychmiast powiadom o tym swoją matkę, ojca lub osobę, która troszczy się o ciebie. Ważne jest, aby nie przyjmować zbyt dużej ilości leku, w przeciwnym razie zachorujesz. Nie należy przerywać przyjmowania leku, dopóki lekarz nie powie, że możesz to zrobić. Ten lek może ci pomóc, ale może zranić kogoś innego. . Mama, tata, dozorca, lekarz lub pielęgniarka mogą ci pomóc.
Należy pamiętać, że LD jest określane tylko u zwierząt. Dla osoby określa się wartości ED, a dla wielu leków wartości TD. Im dłuższy odstęp między ED50 a TD50, tym bezpieczniejsze jest jego użycie:
Jeśli ED99
Jeśli ED1
Jeśli ED1\u003e TD1, lek jest toksyczny.
Jest to uważane za względnie bezpieczne
Stosowanie NLPZ, leków moczopędnych, glikozydów nasercowych itp. Stosowanie leków przeciwnowotworowych, przeciwpsychotycznych i innych prawie zawsze wiąże się z ryzykiem wystąpienia toksycznych powikłań (patrz tabela 1.7).
Treści opublikowane w styczniu Informacje nie mogą być aktualizowane. Zastrzeżenie i przydatne informacje. Pełna lista substancji pomocniczych znajduje się w sekcji. Długotrwałe stosowanie dzieci i młodzieży. Bezpieczeństwo i skuteczność długotrwałego stosowania metylofenidatu nie były systematycznie oceniane przy użyciu kontrolowanych badań. Leczenie metylofenidatem nie powinno i nie powinno być kontynuowane przez czas nieokreślony. Zazwyczaj leczenie metylofenidatem jest przerywane w okresie dojrzewania lub po nim.
Zaburzenia psychiczne, które należy sprawdzić, są wymienione poniżej i obejmują tiki ruchowe lub werbalne, zachowania agresywne lub wrogie, pobudzenie, lęk, depresję, psychozę, manię, majaczenie, drażliwość, brak spontaniczności, introwertyczny i nadmierny upór.
Eksperymenty na zwierzętach nie wykazały wszystkich możliwych reakcji terapeutycznych i niepożądanych. Jest to szczególnie prawdziwe w przypadku skumulowanych efektów i skutków długotrwałego zażywania narkotyków. W tych warunkach trudno jest również określić rzeczywiste działanie teratogenne i mutagenne. Dlatego po przetestowaniu nowych substancji leczniczych na zwierzętach są one badane na ludziach - i dopiero wtedy można je stosować.
Zaleca się przerwanie podawania metylofenidatu co najmniej raz w roku, aby ocenić stan dziecka. Poprawa może utrzymywać się nawet wtedy, gdy lek zostanie tymczasowo zawieszony lub trwale odstawiony. Bezpieczeństwo i skuteczność produktu nie zostały ustalone dla pacjentów w tej grupie wiekowej.
Nie zaleca się stosowania metylofenidatu u pacjentów w podeszłym wieku. Nie ustalono bezpieczeństwa i skuteczności u pacjentów w tej grupie wiekowej. Stosowanie u dzieci poniżej 6 lat. Nie zaleca się stosowania metylofenidatu u dzieci w wieku poniżej 6 lat. Bezpieczeństwo i skuteczność nie zostały ustalone dla pacjentów w tej grupie wiekowej.
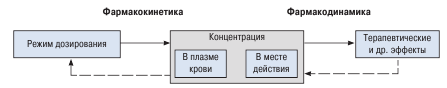
Schemat 1.4.
Podczas badania wpływu leków na zdrowych ochotników określa się minimalne dawki terapeutyczne i minimalne dawki toksyczne. Minimalna dawka terapeutyczna (analog ED1) jest określona przez minimalną ilość substancji leczniczej, którą należy wprowadzić, aby uzyskać efekt terapeutyczny. Minimalna dawka toksyczna (analog TD1) jest określona przez minimalną ilość substancji leczniczej, przy której rozpoczyna się rozwój działań niepożądanych, ubocznych lub toksycznych. Zakres między minimalną dawką toksyczną a terapeutyczną nazywa się zakresem terapeutycznym. Im szerszy zakres terapeutyczny, tym mniejsze prawdopodobieństwo powikłań przy stosowaniu tego leku. Minimalna dawka terapeutyczna i toksyczna substancji leczniczej jest w dużej mierze determinowana przez wprowadzenie substancji leczniczej do organizmu. Dlatego optymalizację terapii farmakologicznej można ograniczyć do utrzymania stężenia substancji leczniczej w danej tkance w zakresie terapeutycznym. Pozwoli to osiągnąć efekt terapeutyczny bez rozwoju skutków ubocznych. Ponieważ w większości przypadków nie jest możliwe określenie stężenia substancji leczniczej w miejscu jej działania (w miejscu podania), stężenie w osoczu krwi jest najczęściej określane w praktyce, ponieważ to stężenie substancji leczniczej w osoczu krwi determinuje jej działanie ogólnoustrojowe: wejście do narządów docelowych i rozwój działania niepożądane Dlatego optymalizację leczenia w celu zwiększenia skuteczności terapii i zmniejszenia ryzyka działań niepożądanych można ograniczyć do określenia stężenia substancji leczniczej w osoczu krwi lub w innych biologicznych środowiskach ludzkiego ciała.
Podczas leczenia metylofenidatami u pacjentów rozwijają się takie objawy, jak kołatanie serca, ból w klatce piersiowej po wysiłku, niewyjaśnione omdlenie, duszność lub inne objawy sugerujące stan serca; należy natychmiast przeprowadzić specjalistyczną ocenę serca.
Krótkoterminowe i długoterminowe konsekwencje kliniczne tych skutków dla układu sercowo-naczyniowego u dzieci i młodzieży są nieznane, ale nie można całkowicie wykluczyć możliwości powikłań klinicznych ze względu na wpływ danych z badań klinicznych. Dlatego należy zachować ostrożność podczas leczenia pacjentów ze stanami klinicznymi, które mogą być upośledzone przez wzrost ciśnienia krwi lub częstości akcji serca.
Dlatego schemat dawkowania substancji leczniczej musi być tak dobrany, aby stężenie substancji leczniczej w osoczu krwi mieściło się w zakresie terapeutycznym. Wzory zmian stężenia leków w organizmie są badane za pomocą farmakokinetyki. Część teoretyczna tej nauki oparta jest na matematycznych metodach analizy procesów zmiany stężenia leków w organizmie. Farmakokinetyka kliniczna opiera się na monitorowaniu terapeutycznym leków (TLM) - określaniu stężenia leków w tkankach biologicznych i płynach, co umożliwia racjonalny wybór indywidualnego schematu dawkowania dla pacjenta w celu osiągnięcia maksymalnego efektu terapeutycznego i bezpieczeństwa.
Stan układu sercowo-naczyniowego powinien być ściśle monitorowany. Ciśnienie krwi i częstość akcji serca należy zapisywać na wykresie etapowym przy każdej zmianie dawki, a następnie co najmniej co 6 miesięcy. Stosowanie metylofenidatu jest przeciwwskazane w przypadku niektórych wcześniej istniejących chorób sercowo-naczyniowych, chyba że jest to zalecane przez specjalistę kardiologii z doświadczeniem w wieku rozwojowym.
Nagła śmierć i istniejące wcześniej strukturalne nieprawidłowości serca lub inne poważne choroby serca. U dzieci, niektóre z wadami serca lub innymi poważnymi problemami z sercem, zgłaszano nagłą śmierć w związku ze stosowaniem stymulantów ośrodkowego układu nerwowego do normalnego stosowania w dawkach pediatrycznych. Chociaż niektóre poważne problemy z sercem same w sobie mogą prowadzić do zwiększonego ryzyka nagłej śmierci, produkty stymulujące nie są zalecane u dzieci i młodzieży ze znanymi zaburzeniami strukturalnymi serca, kardiomiopatią, poważnymi zaburzeniami rytmu serca lub innymi poważnymi problemami z sercem, które mogą uczynić je bardziej podatnymi na efekty sympatykomimetyczne spowodowane przez stymulujący lek na ośrodkowy układ nerwowy.
Farmakokinetyka kliniczna opiera się na istnieniu związku między stężeniem leku dostępnym do oznaczenia (na przykład w osoczu krwi lub krwi pełnej) a jego działaniem (terapeutycznym lub niepożądanym). W przypadku wielu narkotyków jest to rzeczywiście prawda, ale w niektórych przypadkach nie można zidentyfikować takiego związku. Zazwyczaj stężenie leku we krwi jest powiązane z jego stężeniem w tkance docelowej. Kliniczna farmakokinetyka pozwala oszacować zależność wpływu na dawkę i zinterpretować dynamikę stężenia leku w płynach biologicznych. Wybór i korekta schematu leczenia z uwzględnieniem praw farmakokinetycznych pozwala na zwiększenie skuteczności i bezpieczeństwa leczenia farmakologicznego.
Niewłaściwe użycie i efekty sercowo-naczyniowe. Niewłaściwe użycie stymulantów ośrodkowego układu nerwowego może być związane z nagłą śmiercią i innymi poważnymi chorobami układu krążenia skutki uboczne. Sekcja 3 dotycząca chorób naczyniowo-mózgowych, dla których leczenie metylofenidatem jest przeciwwskazane.
Pacjentów z dodatkowymi czynnikami ryzyka należy regularnie monitorować podczas każdej wizyty po rozpoczęciu leczenia metylofenidatem, aby sprawdzić, czy nie występują objawy neurologiczne. Zapalenie naczyń mózgowych jest bardzo rzadką osobliwą reakcją na działanie na metylofenidat. Istnieje niewiele dowodów na to, że można zidentyfikować pacjenta wysokiego ryzyka i że początkowy początek objawów może być pierwszą oznaką poważnego problemu klinicznego. Wczesna diagnoza oparta na wysokim podejrzeniu może pozwolić na szybkie zawieszenie metylofenidatu i terminowe leczenie.
Konieczność zmiany dawki w niektórych stanach fizjologicznych i patologicznych jest często spowodowana zmianą farmakokinetyki leku. Najważniejsze parametry farmakokinetyczne obejmują klirens charakteryzujący eliminację leku, objętość dystrybucji jest pozorną objętością, w której znajduje się lek, okres półtrwania (Tu) jest parametrem, który charakteryzuje szybkość eliminacji leku z organizmu, a biodostępność to proporcja leku podawanego do krążenia ogólnoustrojowego. . Mniej znaczącymi parametrami są szybkość ssania i szybkość dystrybucji.
Dlatego diagnozę tę należy wziąć pod uwagę u każdego pacjenta, u którego podczas leczenia metylofenidatem wystąpią nowe objawy neurologiczne zgodne z diagnozą niedokrwienia mózgu. Objawy te mogą obejmować silny ból głowy, drętwienie, osłabienie, paraliż oraz zmianę koordynacji, widzenia, mowy lub pamięci.
Leczenie metylofenidatem nie jest przeciwwskazane u pacjentów z hemiplegicznym porażeniem mózgowym. W przypadku wystąpienia objawów psychicznych lub pogorszenia wcześniej istniejących objawów psychiatrycznych nie można podawać metylofenidatu, chyba że korzyści wynikające z leczenia przewyższają ryzyko dla pacjenta. Przed rozpoczęciem leczenia rytaliną należy monitorować pacjentów pod kątem obecności zaburzeń psychicznych w historii osobistej i rodzinnej.
Odprawa narkotyków
Jest to najważniejszy parametr farmakokinetyczny, który pozwala wybrać schemat dawkowania w przypadku długotrwałego leczenia. Aby zapewnić niezbędny efekt terapeutyczny i zminimalizować ryzyko wystąpienia działań niepożądanych, średnie stężenie leku w surowicy krwi w stanie stacjonarnym powinno znajdować się w zakresie terapeutycznym. Jeśli biodostępność wynosi 100%, w stanie stacjonarnym szybkość eliminacji leku jest równa szybkości jego przyjmowania.
Szybkość przyjazdu \u003d Cl x Śr. (1,1)
Tam, gdzie szybkość wchodzenia jest ilością leku podaną na jednostkę czasu, C1 jest całkowitym klirensem, a Sredn jest średnim stężeniem leku w surowicy krwi w stanie stacjonarnym. Jeśli znane jest wymagane średnie stężenie leku w surowicy, szybkość przyjmowania można obliczyć na podstawie klirensu.
Najważniejszą cechą kliniczną klirensu jest to, że z reguły nie zależy on od stężenia leku. Faktem jest, że układy odpowiedzialne za eliminację większości leków (enzym, transport) zwykle nie są nasycone, a bezwzględna szybkość eliminacji liniowo zależy od stężenia leku w surowicy krwi. Innymi słowy, eliminacja podlega kinetyce pierwszego rzędu - proporcja leku usuwanego na jednostkę czasu jest stała. Jeśli systemy eliminacji są nasycone, proporcja nie jest stała, ale ilość leku usuwana na jednostkę czasu. W tym przypadku eliminacja jest zgodna z kinetyką zerowego rzędu, a klirens zależy od stężenia leku w surowicy krwi:?
C1 \u003d Vm / (Km + C), (1,2)
Gdzie Km jest stężeniem leku, przy którym szybkość eliminacji wynosi połowę maksimum, Vm to maksymalna szybkość eliminacji, C to stężenie leku w surowicy.
Pojęcie klirensu leku jest podobne do pojęcia klirensu w fizjologii nerek. Zatem klirens kreatyniny jest równy stosunkowi szybkości wydalania kreatyniny z moczem do stężenia kreatyniny w osoczu. Zasadniczo klirens leku jest równy stosunkowi szybkości eliminacji substancji przez wszystkie narządy do stężenia leku w płynie biologicznym.
C1 \u003d wskaźnik eliminacji / C. (1.3)
Jeśli klirens jest stały, szybkość eliminacji jest wprost proporcjonalna do stężenia leku. Klirens nie odzwierciedla ilości eliminowanego leku, ale objętość płynu biologicznego (osocze krwi lub krew pełna), która jest całkowicie usuwana z tej substancji na jednostkę czasu. Wskaźnik ten można obliczyć dla osocza krwi lub krwi pełnej, a także w celu ustalenia klirensu wolnego leku.
Eliminacja leków odbywa się przez nerki, wątrobę i inne narządy. Obliczając klirens dla każdego narządu jako stosunek szybkości eliminacji przez ten narząd do stężenia leku (na przykład w osoczu krwi) i sumując klirens dla wszystkich narządów, otrzymujemy całkowity klirens.
C1poch + C1poch + C1pr \u003d C1, (1.4)
Kiedy S1poch jest klirensem nerkowym, S1pech jest klirensem wątrobowym, S1pr jest klirensem dla innych narządów (leki mogą być metabolizowane w innych narządach, wydalane z kałem, potem, śliną).
W stanie stacjonarnym całkowity luz można wyznaczyć za pomocą równania 1.1. Przy pojedynczym podaniu leku, którego biodostępność wynosi 100%, a eliminacja jest zgodna z kinetyką pierwszego rzędu, całkowity klirens można obliczyć na podstawie prawa zachowania masy i całkowania równania 1.3 w czasie.
C1 \u003d dawka / AUC. (1,5)
Na przykład Klirens propranololu (dla krwi pełnej) wynosi 16 ml / min / kg (1120 ml / min przy masie ciała 70 kg). Lek jest eliminowany głównie przez wątrobę, czyli w ciągu 1 minuty wątroba oczyszcza 1120 ml krwi z propranololu. Klirens nie zawsze odpowiada przepływowi plazmy (lub krwi) przez ciało odpowiedzialne za wydalanie. Jeśli lek wiąże się z czerwonymi krwinkami, szybkość jego dostarczania do tego narządu jest znacznie wyższa niż można to założyć na podstawie stężenia leku w osoczu krwi. W stanie stacjonarnym klirens osocza krwi i krwi pełnej jest następujący:
C1n / C1k \u003d Сk / \u003dn \u003d 1 + Ht x [Се / Сn -1], (1.6)
Gdzie C1n jest klirensem dla osocza krwi, C1k jest klirensem dla pełnej krwi, Cn jest stężeniem leku w osoczu krwi, Ck jest stężeniem leku w pełnej krwi, Ce jest stężeniem leku w czerwonych krwinkach, Ht jest hematokrytem.
Zatem klirens dla pełnej krwi jest równy ilorazowi podziału klirensu dla osocza krwi przez stosunek stężeń leku w pełnej krwi i osoczu krwi.
Dystrybucja
Wielkość dystrybucji
Ten drugi najważniejszy parametr farmakokinetyczny charakteryzuje dystrybucję leku w organizmie. Objętość dystrybucji (V) jest równa stosunkowi całkowitej substancji w organizmie (CCA) do jej stężenia (C) w osoczu krwi lub pełnej krwi. Objętość dystrybucji często nie odpowiada żadnej rzeczywistej objętości. Objętość ta jest niezbędna do jednolitego rozkładu substancji w stężeniu równym stężeniu tej substancji w osoczu krwi lub krwi pełnej.
Vp \u003d CCA / C. (1,7)
Objętość dystrybucji odzwierciedla proporcję substancji zawartej w przestrzeni pozanaczyniowej. U osoby o wadze 70 kg objętość osocza krwi wynosi 3 l, Bcc wynosi około 5,5 l, płyn pozakomórkowy wynosi 12 l, całkowita zawartość wody w organizmie wynosi około 42 l. Jednak objętość dystrybucji wielu substancji leczniczych jest znacznie większa niż te wartości. Na przykład, jeśli osoba o masie 70 kg zawiera 500 mikrogramów digoksyny w swoim ciele, jego stężenie w osoczu wynosi 0,75 ng / ml. Dzieląc całkowitą zawartość digoksyny w organizmie przez jej stężenie w osoczu krwi, stwierdzamy, że objętość dystrybucji digoksyny wynosi 650 l. Jest to ponad 10-krotność całkowitej zawartości wody w organizmie. Faktem jest, że digoksyna jest dystrybuowana głównie w mięśniu sercowym, mięsień szkieletowy i tkankę tłuszczową, tak że jej zawartość w osoczu jest niska. Objętość dystrybucji leków, które aktywnie wiążą się z białkami osocza (ale nie ze składnikami tkanki) w przybliżeniu odpowiada objętości osocza krwi. Jednak niektóre leki są zawarte w osoczu głównie w postaci związanej z albuminami, ale mają dużą objętość dystrybucji z powodu odkładania się w innych tkankach.
Okres półtrwania
Okres półtrwania (T1 / 2) to czas, w którym stężenie substancji w surowicy krwi (lub jej całkowitej zawartości w ciele) jest zmniejszone o połowę. W modelu jednokomorowym określenie T1 / 2 jest bardzo proste. Otrzymaną wartość wykorzystuje się następnie do obliczenia dawki. Jednak w przypadku wielu leków konieczne jest zastosowanie modelu wielokomorowego, ponieważ dynamikę ich stężenia w surowicy krwi opisuje kilka funkcji wykładniczych. W takich przypadkach obliczanych jest kilka wartości T1 / 2.
Obecnie powszechnie przyjmuje się, że Ti zależy od klirensu i objętości dystrybucji substancji. W stanie stacjonarnym związek między Ti, klirensem i objętością dystrybucji substancji jest w przybliżeniu opisany następującym równaniem:
T1 / 2 "0,693 x Vp / Cl. (1.8)
Prześwit charakteryzuje zdolność organizmu do eliminacji substancji, dlatego wraz ze spadkiem tego wskaźnika z powodu wzrostu choroby T1 / 2. Ale jest to prawdą tylko wtedy, gdy objętość dystrybucji substancji nie zmienia się. Na przykład z wiekiem wzrasta T diazepam, ale nie z powodu zmniejszenia klirensu, ale z powodu wzrostu objętości dystrybucji (Klotzet i in., 1975). Stopień wiązania substancji z osoczem krwi i białkami tkankowymi wpływa na klirens i objętość dystrybucji, dlatego należy przewidzieć zmianę T1 / 2 dla jednego lub drugiego stan patologiczny nie zawsze możliwe.
Za pomocą T1 / 2 nie zawsze można ocenić zmianę w eliminacji leku, ale ten wskaźnik pozwala obliczyć czas do osiągnięcia stanu stacjonarnego (na początku leczenia, a także przy zmianie dawki lub częstotliwości podawania). Stężenie substancji leczniczej w surowicy krwi, które wynosi około 94% średniej stacjonarnej, osiąga się w czasie równym 4 x T1 / 2. Ponadto, używając T1 / 2, możesz oszacować czas wymagany do całkowitego usunięcia substancji z organizmu i obliczyć odstęp między wstrzyknięciami.
Biodostępność i szybkość wchłaniania
Biodostępność
Jak wspomniano powyżej, nie wszystkie wchłonięte leki dostają się do krążenia ogólnego. Ilość leku, który wchodzi do krążenia układowego, zależy nie tylko od dawki, ale także od biodostępności. To ostatnie zależy od stopnia wchłaniania, a także stopnia eliminacji, na który lek jest narażony przed wejściem do krążenia ogólnoustrojowego. Oprócz niepełnego wchłaniania (patrz wyżej), niska biodostępność może być spowodowana intensywnym metabolizmem w jelitach lub wątrobie lub wydalaniem z żółcią.
Szybkość ssania
Szybkość wchłaniania z reguły nie wpływa na średnie stężenie leku w surowicy krwi w stanie stacjonarnym, ale może znacząco wpływać na działanie farmakologiczne. Jeśli lek szybko dostanie się do krążenia ogólnoustrojowego (na przykład przez podanie dożylne) i początkowo zostanie rozprowadzony w małej objętości, jego stężenie w surowicy krwi może być dość wysokie. Ponieważ lek jest dystrybuowany do mniej intensywnie krążących narządów i tkanek, zmniejsza się. Jeśli lek dostanie się do krążenia układowego wolniej (na przykład w infuzji dożylnej), jego dystrybucja rozpoczyna się jeszcze przed podaniem całej dawki. Dlatego maksymalne stężenie w surowicy krwi jest niższe i osiągane jest później. Leki długo działające zapewniają powolne, równomierne wchłanianie leków, zmniejszając wahania stężenia leku w surowicy krwi między podaniami. Szybkość dystrybucji substancji leczniczej w różnych tkankach docelowych może być różna, dlatego też, gdy zmienia się szybkość podawania, nasilenie efektów terapeutycznych i działań niepożądanych może tymczasowo ulec zmianie.
Wybór dawki i dostosowanie
Efekt terapeutyczny po pojedynczym wstrzyknięciu leku pojawia się jakiś czas po wprowadzeniu, maksimum jest stopniowo osiągane, a następnie słabnie i znika.
Jego dynamika odpowiada stężeniu leku w surowicy krwi, co zależy od jego właściwości farmakologicznych (wchłanianie, dystrybucja, eliminacja). Efekt terapeutyczny pojawia się po osiągnięciu stężenia terapeutycznego i rośnie wraz ze wzrostem. Czas trwania efektu zależy od czasu, w którym stężenie leku w surowicy krwi przekracza terapeutyczny. Podobnie, działania niepożądane zależą od toksycznego stężenia leku. W zakresie między tymi stężeniami (zakres terapeutyczny) lek jest skuteczny, ale nie wykazuje działań niepożądanych. Przy wielokrotnym podawaniu leku dawkę i odstęp między podaniami dobiera się w taki sposób, aby osiągnąć maksymalny efekt terapeutyczny przy minimalnych skutkach ubocznych. Dolną granicą zakresu terapeutycznego z reguły jest stężenie leku w surowicy, przy którym efekt terapeutyczny wynosi około połowy maksimum. Górna granica odpowiada stężeniu, w którym działania niepożądane występują u nie więcej niż 5–10% pacjentów. Stężenie toksyczne niektórych leków jest mniejsze niż dwukrotność stężenia terapeutycznego. Należy pamiętać o indywidualnych cechach pacjentów: niektóre dobrze tolerują stężenie leku w surowicy krwi, które przekracza toksyczność, podczas gdy inne mają wyraźne działania niepożądane, gdy stężenie w surowicy krwi pozostaje w zakresie terapeutycznym.
Jeśli efekty farmakologiczne leków są łatwe do oceny (na przykład przez zmiany ciśnienia krwi lub glukozy we krwi), dawkę można wybrać metodą prób i błędów. Aby określić zakres i częstotliwość zmiany dawki, stosuje się zasady empiryczne, które uwzględniają powyższe wzorce farmakologiczne (na przykład dawka zmienia się o nie więcej niż 50% i nie więcej niż 3-4 TI). Jeśli nie ma toksyczności zależnej od dawki, aby zapewnić maksymalną skuteczność i wydłużyć czas działania leku, można go stosować w dawce znacznie wyższej niż średnia dawka terapeutyczna. Na przykład robią to z większością blokerów p-adrenoreceptorów.
Jeśli efekty farmakologiczne są trudne do oceny, lek ma wąski zakres terapeutyczny, wysokie ryzyko działań niepożądanych z niepowodzeniem leczenia lub lek stosuje się w celach profilaktycznych, dawkę nieznacznie zmienia się, uważnie obserwując pacjentów w celu zidentyfikowania działań niepożądanych. Tak czy inaczej średnie stężenie leku w stanie stacjonarnym powinno mieścić się w zakresie terapeutycznym. W większości przypadków nie ma potrzeby określania rzeczywistego stężenia leku w surowicy krwi: wystarczy wiedzieć, jak to zależy od dawki i częstotliwości podawania. Jednak w przypadku niewielkiej liczby leków stężenie terapeutyczne różni się od toksycznego tylko 2-3 razy (digoksyna, teofilina, lidokaina, aminoglikozydy, cyklosporyny, leki przeciwdrgawkowe) w stanie stacjonarnym, w którym jest skuteczne, ale powoduje minimum działań niepożądanych. Następnie zmierz rzeczywiste stężenie leku i, jeśli to konieczne, dostosuj dawkę, tak aby faktyczne stężenie było jak najbardziej zbliżone do pożądanego.
Dawka podtrzymująca
W większości przypadków leki podaje się ułamkowo lub we wlewie, tak aby stężenie stacjonarne mieściło się w zakresie terapeutycznym. W stanie stacjonarnym szybkość przyjmowania leku jest równa jego szybkości eliminacji. Podstawiając do równania wymagane stężenie leku w surowicy krwi, otrzymujemy:
Szybkość przyjazdu \u003d Średnia * C1 / F, (1,9)
Gdzie F oznacza dostępność biologiczną.
Znając wymagane stężenie leku w surowicy, jego klirens i biodostępność, można obliczyć dawkę i częstotliwość podawania.
Dawkę i częstotliwość podawania (tj. Szybkość przyjmowania leku) można obliczyć na podstawie równania 1.9. Biodostępność digoksyny wynosi 0,7.
Szybkość wejścia \u003d średnia C, * C1 / F \u003d 1,5 ng / ml * 1,6 / 0,7 ml / min / kg \u003d 3,43 ng / kg / min \u003d 236 ng / min \u003d 236 * 60 * 24 / 1000 μg / dzień \u003d 340 μg / dzień \u003d 0,34 mg / dzień.
W praktyce dawkę zaokrągla się do najbliższego standardu, na przykład do 375 μg / dzień lub do 0,25 mg / dzień. W pierwszym przypadku średnie stężenie w osoczu krwi w stanie stacjonarnym będzie wynosić 1,5 x 375/340 \u003d 1,65 ng / ml, w drugim - 1,5 x 250/340 \u003d 1,1 ng / ml. ?
Odstęp między administracjami
Pożądane jest, aby w odstępie między wstrzyknięciami nie występowały gwałtowne wahania stężenia leku w surowicy krwi. Gdyby wchłanianie i dystrybucja leku nastąpiła natychmiast, wielkość tych wahań zależałaby tylko od Ti. Gdy odstęp między podaniami jest równy Ti, minimalne i maksymalne stężenie różnią się 2 razy, co jest całkiem do przyjęcia.
Jeśli zakres terapeutyczny leku jest wystarczająco szeroki, to znaczy w stężeniach znacznie wyższych niż terapeutyczny jest dobrze tolerowany, można przepisać maksymalne dawki. W takim przypadku odstęp między wstrzyknięciami może być znacznie większy niż T, co jest bardzo wygodne dla pacjenta.
W przypadku leku o wąskim zakresie terapeutycznym często konieczne jest zmierzenie maksymalnego i minimalnego stężenia leku w surowicy. Minimalne stężenie digoksyny w stanie stacjonarnym (Cmin) oblicza się według następującego równania:
Gdzie k \u003d 0,693 / Tu, a T to przerwa między podaniami. Wartość e-CT reprezentuje proporcję poprzedniej dawki pozostającej w ciele w czasie następnej dawki (biorąc pod uwagę biodostępność).
Dawka nasycająca może być przyjmowana doustnie lub dożylnie. Aby zmniejszyć ryzyko wystąpienia działań niepożądanych, zostaje zmiażdżony. Początkowo podaje się 0,5 mg, po 6-8 godzinach - kolejne 0,25 mg, uważnie obserwując pacjenta. Ostatnie 0,25 mg, jeśli to konieczne, można również podzielić na 2 dawki 0,125 mg i podawać w odstępach 6-8 godzin, szczególnie jeśli planowane jest przejście na podawanie digoksyny w dawce podtrzymującej w ciągu 24 godzin od rozpoczęcia leczenia.
Indywidualny wybór dawki
Schemat leczenia określa się na podstawie wzorów wchłaniania, dystrybucji i eliminacji leku oraz parametrów farmakokinetycznych C1, Ur i T1 / 2). Zalecane schematy leczenia są zwykle zaprojektowane dla „przeciętnego” pacjenta. W przypadku wielu leków odchylenie standardowe parametrów, takich jak F, C1 i Ur wynosi odpowiednio 20; 50 i 30%. Innymi słowy, w 95% przypadków stężenie leku w surowicy krwi w stanie stacjonarnym mieści się w zakresie od 35 do 270% wymaganego, co jest niedopuszczalne w przypadku leków o wąskim zakresie terapeutycznym. Dlatego indywidualny dobór dawki i częstotliwości podawania jest najważniejszym warunkiem skuteczności leczenia. W oparciu o opisane powyżej wzorce farmakologiczne reżim leczenia dobiera się w taki sposób, aby zapewnić niezbędny efekt terapeutyczny i zminimalizować ryzyko działań niepożądanych. Jeśli to możliwe, zmierz stężenie leków w surowicy krwi. Na podstawie danych uzyskanych za pomocą specjalnych technik koryguje się dawkę leków o wąskim zakresie terapeutycznym (na przykład glikozydy nasercowe, leki przeciwarytmiczne, difenina, teofilina).
Ilościowe i jakościowe metody farmakokinetyki są złożone i kosztowne w zwykłym stosowaniu, co również nie jest uzasadnione w wielu przypadkach, ponieważ istnieją dobrze ustalone schematy dawkowania leków i ich korekty, biorąc pod uwagę indywidualne cechy pacjentów. Jednak w niektórych przypadkach wymaga to monitorowania terapeutycznego narkotyków, co jest wymagane w następujących sytuacjach, które są przede wszystkim powiązane (Belousov Yu.B., Gurevich K.G., 2005):
1. Znacząca indywidualna zmienność parametrów farmakokinetycznych leków. Na przykład istnieją przypadki, w których działanie terapeutyczne leku w osoczu krwi osiągnięto przy minimalnym stężeniu terapeutycznym. W związku z tym obserwowano ostre działanie hepatotoksyczne związane ze stosowaniem paracetamolu w osoczu krwi zgodnie z korytarzem terapeutycznym i wykluczono inne czynniki, które mogą prowadzić do takich powikłań (na przykład alkoholizm).
2. Cechy farmakokinetyki u dzieci i osób starszych. Ten pierwszy zauważył znaczne różnice w rozwoju metabolizmu i wydalania substancji leczniczej. U prawie wszystkich osób starszych zidentyfikowano choroby, które zmieniają parametry farmakokinetyczne znanych leków lub wymagają złożonej terapii, w której mogą wystąpić nieprzewidziane interakcje z innymi lekami. Ponadto wraz z wiekiem, nawet u osób bez chorób nerek, obserwuje się zmniejszenie klirensu kreatyniny w nerkach, co charakteryzuje zmniejszenie skuteczności systemu eliminacji leków.
3. Wąski zakres terapeutyczny leku, wysokie prawdopodobieństwo wystąpienia działań niepożądanych, nawet przy zastosowaniu minimalnych stężeń terapeutycznych leku.
4. Okres ciąży, karmienia piersią i inne stany, w których konieczne jest całkowite wyeliminowanie ryzyka niepożądanych reakcji na leczenie farmakologiczne lub sytuacje, w których parametry farmakokinetyczne leków znacznie się zmieniają.
5. Nieliniowa farmakokinetyka leków, gdy nie ma wyraźnego związku między stężeniem substancji leczniczej we krwi a efektem terapeutycznym. W takim przypadku postuluje się zwykle, że rozwój działań niepożądanych jest związany ze zmianą stężenia substancji leczniczej w osoczu krwi lub tkance efektorowej.
6. Choroby zmieniające parametry farmakokinetyczne leków: niewydolność serca, niewydolność wątroby i nerek, choroby przewodu pokarmowego.
7. Potrzeba kompleksowego leczenia, nieprzewidywalność efektów skojarzonej farmakoterapii. W takim przypadku pacjent powinien wziąć pod uwagę leki dostępne bez recepty, składniki ziołowe, a także charakter diety. Zazwyczaj konieczne jest monitorowanie terapeutyczne leków przy jednoczesnym stosowaniu\u003e 5 leków, w tym miejscowych postaci dawkowania, preparatów witaminowych, hormonalnych środków antykoncepcyjnych, leków tradycyjna medycyna, substancje homeopatyczne itp. Jednak w przypadku przepisywania silnych leków lub mających ten sam układ metaboliczny lub we wszystkich przypadkach określonych w klauzulach 1-6, terapeutyczne monitorowanie leków może być wymagane, nawet jeśli stosuje się\u003e 2 leki.
przepisywanie leków w określonej ilości (dawce) lub w określonym stężeniu (przy stosowaniu miejscowym lub wziewnym).
Istnieją pojedyncze dawki (ilość leku na dawkę), dawki dzienne (ilość leku przepisanego na dzień w jednej lub więcej dawkach), dawki oczywiście (całkowita ilość leku na kurs leczenia). Jeśli to konieczne, szybko stwórz na początku leczenia wysokie stężenie substancji leczniczej w organizmie, leki są przepisywane w tak zwanych dawkach wstrząsowych, które przekraczają kolejne pojedyncze dawki.
Dawki, w których lek stosuje się w celach terapeutycznych lub profilaktycznych, nazywa się terapeutycznymi. Wśród nich wyróżnia się próg lub działanie minimalne, średnie dawki terapeutyczne i wyższe dawki terapeutyczne. Najwyższe dawki terapeutyczne (pojedyncze i dzienne) dla toksycznych i silnych leków podano w Farmakopei Państwowej ZSRR w artykułach na temat poszczególnych leków, a także w dwóch tabelach podsumowujących, w których oddzielnie podano najwyższe dawki terapeutyczne dla dorosłych i dzieci. W przypadku dzieci podaje się je zgodnie z wiekiem (dla dzieci poniżej 6 miesięcy, od 6 miesięcy do 1 roku, w wieku 2 lat, w wieku 3-4 lat, 5-6 lat, 7-9 i 10-14 lat). Zakres dawek terapeutycznych, tj. odstęp między progiem a najwyższymi dawkami terapeutycznymi jest oznaczony terminem „szerokość terapeutyczna”. Ponieważ dawki progowe są rzadko stosowane w praktyce, szerokość terapeutyczną leków zwykle ocenia się na podstawie odstępu między średnimi a wyższymi dawkami terapeutycznymi. Im większa szerokość terapeutyczna leku, tym bezpieczniejsze jego stosowanie (mniejsze ryzyko przedawkowania).
Dawki są zwykle podawane w gramach lub ułamkach grama. Przy niewielkiej ilości terapeutycznych leków czasami podaje się je na 1 kg masa ciała (np. 1 mg / kg) lub na jednostkę powierzchni ciała (np. 1 mg / m2) Dawki substancji leczniczych przekraczające najwyższe terapeutyczne określa się jako toksyczne. Przy tych dawkach leki mogą powodować działania toksyczne, które są szkodliwe dla organizmu. Ponadto izolowane są dawki śmiertelne.
Wraz ze wzrostem dawki leku utajony okres jego działania zwykle maleje, zwiększa się wielkość i czas trwania efektu.
W praktyce eksperymentalnej średnie skuteczne dawki (ED 50), tj. dawki, które powodują określony efekt farmakologiczny (na przykład pozycja boczna, podwyższony próg wrażliwości na ból itp.) u 50% zwierząt doświadczalnych, a także średnie dawki śmiertelne (śmiertelne) (LD 50), tj. dawki powodujące śmierć 50% zwierząt doświadczalnych na określony czas. Związek - oznaczony terminem „wskaźnik terapeutyczny”. Porównując ED50 dwóch lub więcej leków, można ocenić ich względną aktywność (na przykład, jeśli ED50 leku A jest 2 razy mniejszy niż ED50 leku B, wtedy lek A jest 2 razy bardziej aktywny niż lek B). Względną skuteczność substancji ocenia się na podstawie maksymalnego efektu farmakologicznego.
Wartość skutecznych dawek zależy od biodostępności leków i odpowiednio od ich stężenia w osoczu krwi. Dlatego też najdokładniejszy wybór skutecznych dawek jest możliwy, pod warunkiem określenia biodostępności leków u określonych pacjentów.
Przy tych samych dawkach substancji leczniczej nasilenie jej działania terapeutycznego może być różne, co zależy od różnic we wrażliwości organizmu na leki pod wpływem wielu czynników (wiek, płeć, stan funkcjonalny organizmu, powtarzane podawanie leku, czas jego podawania w ciągu dnia itp. ) W niektórych przypadkach zmiany wrażliwości organizmu na jednostkę narkotyki może być bardzo wyraźny, co wymaga odpowiedniego dostosowania dawki takich leków.
Tak więc, w związku ze wzrostem wrażliwości organizmu na leki, a u osób starszych, pacjentów w wieku powyżej 60 lat, leki, które depresją centralnego naukowca (środki nasenne, leki przeciwpsychotyczne, narkotyczne środki przeciwbólowe, bromki), glikozydy nasercowe i leki moczopędne są przepisywane w dawkach 1/2, a inne toksyczne i silne leki w dawkach 2/3 dawek dla osób w średnim wieku. Antybiotyki, sulfonamidy i preparaty witaminowe są zwykle przepisywane osobom starszym w takich samych dawkach jak ludzie w średnim wieku.
